|
Teil Heim
Produktion, Amateur Funkamateur Modellflugzeuge, Raketen- Nützlich, unterhaltsam |
Stealth - Master
Elektronik Physik der Technik Erfindung |
Raum Geheimnis
Erde Mysteries Secrets of the Ocean List Kartenausschnitt |
|
| Verwendung des Materials ist für die Referenz (für Websites - Hyperlinks) zulässig | |||
Navigation: => |
Startseite / Produkte Patente / In der Sektion des Kataloges / zurück / |
|
Erfindung
Russische Föderation Patent RU2167211
![]()
Umweltfreundliche Weise zu Rückgewinnung von Edelmetallen
VON MATERIALIEN ENTHALTENDE
Name des Erfinders: Vladimir Gurov
Der Name des Patentinhabers: Vladimir Gurov; Yuri Dorofeew Nikanorovich; Koltsov Vasily Yurevich; Snigir Alexander
Adresse für die Korrespondenz:
Startdatum des Patents: 2000.10.26
Die Erfindung betrifft Metallurgie, insbesondere auf Verfahren zur Rückgewinnung von Edelmetallen.
Verfahren zur Extraktion von Edelmetallen aus Materialien , welche diese enthalten, Materialien umfassen Laugungslösung Chloridionen enthaltenden, zur Einführung in der Laugungslösung von Schwefelsäure und Wasserstoffperoxid produktives nachfolgenden Verarbeitungslösung mit der Gewinnung von Edelmetallen und recycelten Laugungslösung zurückkehrt. Somit Schwefelsäure und Wasserstoffperoxid in der Laugungslösung als ein Gemisch eingeführt wird, wird das Mischen durch Einleiten von Wasserstoffperoxid zu Schwefelsäure bei einem molaren Verhältnis von 2SO 4 durchgeführt: H 2 O 2> 1 ist , und Kühlen. Die Verwendung der Erfindung verringert Reagenzienverbrauch und die Umweltsicherheit und die Sauberkeit des Prozesses.
BESCHREIBUNG DER ERFINDUNG
Die Erfindung betrifft Metallurgie, insbesondere Verfahren für die Edelmetalle produziert und kann verwendet werden , um zu extrahieren Gold, Silber und Platingruppenmetallen aus Erzen, Konzentraten, Schlacken, Schwänze, gebrauchte Katalysatoren, Elektronikschrott, usw.
Das Verfahren zur Gewinnung von Edelmetallen aus Erzen, Konzentraten, Abfall und recycelten Lösung , die Ionen H, Cl und NO 3, beispielsweise eine Lösung 50-350 g / l und NCl 3-50% HNO 3 bei einer Temperatur von 20-110 o C , enthaltend . Nach der Abtrennung von Metallen aus der verbrauchten Lösung recycelten Lösung (DE 2.418.441).
Die Nachteile des Verfahrens ist der hohe Verbrauch an Salpetersäure weil für die Effizienz des Verfahrens, muss es eine hohe Konzentration und eine niedrige und umweltfreundliche Art und Weise im Hinblick auf den Erhalt als Abfall Stickoxid sein.
Gewählt als Prototyp ein Verfahren zur Extraktion von Edelmetallen aus Materialien sie enthaltenden Behandlungsmaterialien zirkulierende Laugungslösung Mischung aus Salzsäure und Schwefelsäure unter Zugabe von Wasserstoffperoxid , gefolgt durch die Verarbeitung produktive Lösung ( "Rh, Pt und Pd Wiederherstellung enthält , von New und Apent Automative Catalysts" / / Wu Koo Ying et. al. Precious Metals, 1993, N 17, Seite 343-349).
Bei diesem Verfahren führt die Zugabe von Wasserstoffperoxid zu einer Lösung von Chlorwasserstoffsäure und Schwefelsäure in einem erhöhten Verbrauch von Reagenzien, die die Wahrscheinlichkeit der Bildung und Freisetzung von elementarem (gasförmigem) Chlor erhöht Menge an Prozesssicherheit und des Umwelt Reinheit verringert wird.
Aufgabe der Erfindung ist es, den Verbrauch an Reagenzien und erhöht die Umweltsicherheit und die Sauberkeit des Prozesses zu reduzieren.
Diese Aufgabe wird durch ein Verfahren zur Gewinnung von Edelmetallen aus Materialien , die sie erreicht, wobei die Materialien mit einer Lösung Auslaugen Chloridionen enthält, in der Laugungslösung von Schwefelsäure und Wasserstoffperoxid, eine nachfolgende Verarbeitung produktive Lösung mit der Gewinnung von Edelmetallen Einführung und gibt die verarbeitete Lösung H 2 O 2> 1, und Kühlung: Auslaugen, Schwefelsäure und Wasserstoffperoxid in der Laugungslösung als ein Gemisch eingeführt wird, wird das Mischen durch Einleiten von Wasserstoffperoxid zu Schwefelsäure bei einem molaren Verhältnis von H 2 sO 4 durchgeführt.
Zusammenfassung der Erfindung ist wie folgt. Wenn sie in die Laugungslösung Ionen und Schwefelsäure enthält Chlorid eingeführt, wie Kälte oder durch eine Mischung aus Schwefelsäure und Salzsäure Erhitzen durch Umsetzung
2Cl - + H 2 SO 4 = SO 42- + 2HCl (1)
Die oxidative Wirkung von Wasserstoffperoxid wird durch Halbreaktion beschrieben
H 2 O 2+ 2H + + 2e = 2H 2 O, (2)
der Wert der Standard Oxidations-Reduktionspotential (ORP), die + 1,776 in.
Reaktionen Auflösen Edelmetalle wie Gold und Platin, mit Salzsäure und Wasserstoffperoxid wird die Form
2Au + 3H 2 O 2 + 8HCl = 2HAuCl 4 + 6H 2 O (3)
Pt + 2H 2 O 2 + 6HCl = H 2 PtCl 6 + 4H 2 O (4)
In diesem Standard - AFP Gold Auflösung in einem Chlorid - Medium (1,0 in) und Platin (0,7 in), signifikant die ORP von Wasserstoffperoxid senken. Jedoch ist die tatsächliche Oxidationsaktivität von Wasserstoffperoxid nur bei hohen pH-Wert und signifikante Konzentrationen an Wasserstoffperoxid und Chloridionen in der Lösung gezeigt. Wenn jedoch der Vormischung Wasserstoffperoxid und konzentrierter Schwefelsäure, die Schwefelsäure und einen Teil von Wasserstoffperoxid und permonosulphuric Form Perschwefelsäure durch die Reaktionen
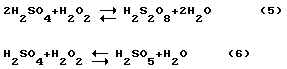
Perschwefelsäure und permonosulphuric sind viel stärker und aktiveren Oxidationsmittel als Wasserstoffperoxid (ORP = 2,12 in). Reaktionen (5, 6), die beide reversible und deutlich Perschwefelsäure und zersetzen sich bei erhöhter Temperatur und Verdünnung, sowie Wasserstoffperoxid. Wenn ein Gemisch von Wasserstoffperoxid jedoch und konzentrierter Schwefelsäure unter Kühlung in cook Temperaturbereich 0-30 ° C und unmittelbar nach der Herstellung verwendet wird , den größten Teil des Wasserstoffperoxids in Permonoschwefelsäure umgewandelt.
Darüber hinaus ist die Reihenfolge der Vermischung zu Wasserstoffperoxid und Schwefelsäure eingestellt. Wenn in Schwefelsäure, Wasserstoffperoxid verabreicht, daß durch Mischen von Verdünnungswasser erzeugt Perschwefelsäure Säuren und deren Zersetzung wird zunächst auf Wasserstoffperoxid beobachtet, und dann an Sauerstoff. Das Ergebnis wird sein unproduktiver Verlust an Wasserstoffperoxid verwendet. Wenn Wasserstoffperoxid in Schwefelsäure verabreicht, wird der Perschwefelsäure Schwefelsäure verdünnt werden, was ihren Widerstand erhöht. Als Ergebnis wird die Umwandlung von Peroxid zu Perschwefelsäure wesentlich vollständig. Aus den gleichen Gründen sollte die molare Konzentration der Schwefelsäure in der Endmischung größer als die molare Konzentration von Wasserstoffperoxid. Mit anderen Worten ist die fertige Mischung einen molaren Überschuss an Schwefelsäure nach Reaktion (6) enthält, d.h. Es muss Verhältnis von H 2 SO 4 eingehalten werden: H 2 O 2> 1
Wenn sie in der Laugungslösung von Wasserstoffperoxid in einer Mischung von Schwefelsäure eingeführt erhaltene Perschwefelsäure zerlegt, jedoch deutlich langsamer als Wasserstoffperoxid selbst. Außerdem zersetzt sich Wasserstoffperoxid in Sauerstoff und Wasser und Perschwefelsäure weitgehend Ozon zersetzen. Wenn Sauerstoff unter diesen Bedingungen ist kein Oxidationsmittel für das Edelmetall und das sich ergebende Ozon ist ein Oxidationsmittel und ein stärker und aktiver als Wasserstoffperoxid. Als Ergebnis der Vormischen führt Wasserstoffperoxid mit Schwefelsäure zur gleichzeitigen Aktivierung und Stabilisierung von Wasserstoffperoxid. Die Folge dieser Tatsache ist, eine reale Möglichkeit, eine wesentlich geringere Konzentration des Oxidationsmittels, Säure und Chloridionen in der Laugungslösung zu erhalten, während die Auflösung der Edelmetalle bieten. Als Folge der geringeren Verbrauch.
AFP Bildung von elementarem Chlor wird auf 1,36 und ORP - Werte zwischen Edelmetallen und Wasserstoffperoxid. Halbreaktionsbildung von Chlor hat die Form
Cl 2+ 2e = 2Cl - (7)
Obwohl die Halbreaktion von (7) folgt, daß die Wahrscheinlichkeit der Bildung von elementarem Chlor nur von der Konzentration von Chloridionen abhängig ist, in der Tat hängt es von der Acidität der Lösung. Die Tatsache , dass das elementare Chlor hydrolysiert hypochloriger Säure zu bilden ORP mit wesentlich größer ist als die von Chlor (1,63 in) und eine erhöhte Acidität hemmt Hydrolyse und erleichtert die Oxidation von Chloridionen zu elementarem Chlor. Deshalb, wenn das Blei Auslaugung bei hohen Azidität und die Konzentration der Chloridionen, die Wahrscheinlichkeit der Bildung von elementarem Chlor zunimmt. Umgekehrt, bei einer niedrigeren Konzentration an Säure und Chloridionen verringert diese Wahrscheinlichkeit. Somit ist die Fähigkeit, niedrigere Konzentrationen an Oxidationsmittel, Säure und Chloridionen aufrechtzuerhalten, indem Wasserstoffperoxid in einer Mischung Zugabe verringert die Wahrscheinlichkeit der Bildung von elementarem Chlor und verbessert die Prozesssicherheit und des Umwelt Reinheit.
All das eingeführte Wasserstoffperoxid kann mit einem Teil der gesamten injizierten Schwefelsäure gemischt werden, wenn die Azidität erforderlich ist, aufrechtzuerhalten relativ hoch, wie beispielsweise Platin Auslaugung. In diesem Fall wird der andere Teil in die Schwefelsäure eingeführt Laugungslösung vor der Zugabe des Peroxids Mischung. Bei Bedarf mit einem niedrigen pH, beispielsweise in die Auslaugung von Golderz zu halten, die alle das Peroxid vermischt man mit der Schwefelsäure alle Eingangs- und beide Reaktanden zu der Laugungslösung nur in einer Mischung gegeben. Das Verhältnis von Wasserstoffperoxid und Schwefelsäure kann ganz allgemein in Abmischung variieren: in Abhängigkeit von den Konzentrationen der Reaktanden in den Ausgangsreagenzien, sondern auch eine Verringerung der Säure und auslaugbare Erzen und Behältermaterialien. Wichtig und während des Mischens und nach einer Endmischung sichergestellt molarer Überschuß an Schwefelsäure. Vorzugsweise ist das Wasserstoffperoxid in der Quelle Reagens im Bereich von 30-60% und der Schwefelsäure enthalten ist - im Bereich von 92-98%. Wenn das Rühren Verfahrensausführungs Peroxid-Mischung kann direkt in der Auslaugaufschlämmung als kalt oder durch Erhitzen verzichtet. Im Fall der Haufenlaugung und unterirdischen Edelmetall Mischung aus Wasserstoffperoxid und Schwefelsäure zu der Laugungslösung zugesetzt werden, bevor sie direkt aus der Laugung von Erzen zugeführt wird. Die Quelle von Chloridionen in der Extraktionslösung kann als die Chloride von Alkali- und Erdalkalimetallen und Salzsäure und Aluminiumchlorid und andere Chloride dienen. Die Verarbeitung einer Produktionslösung mit traditionellen Methoden hergestellt: Sorption, Elektrolyse oder Zementierung, mit der Rückkehr der Arbeitslösung Auslaugung.
Nach dem bekannten und bietet die Möglichkeit, die Verarbeitung mit einer Laugungslösung durchzuführen Platin-Aluminiumoxid-Katalysator Aluminiumchlorid enthält. Die Behandlung wurde unter Rühren auf einem Magnetrührer und einer Temperatur von 80 o C in einem hermetisch verschlossenen Glasgefäßen durchgeführt. Die Gefäße wurden mit Vorrichtungen ausgerüstet , um mit einer Lösung von Kaliumhydroxid 200 g / l gefüllt Reagenzien und Abgas durch hydraulische Verriegelungen Abgabe. Gemäß einer Ausführungsform einer bekannten Konzentration der Lösung waren: Cl - 8 M, H 2 SO 4 - 2,5 M, 30% iges Wasserstoffperoxid innerhalb von 1 Stunde eine Anzahl von unterschiedlichen Berechnungs 10-100 g pro 1 kg des Katalysators dosiert wird.
Gemäß einer Ausführungsform der vorgeschlagenen Konzentration waren: Cl - 2M, H 2 SO 4 - 0,5 m. 1 Volumen Schwefelsäure und 1 Volumen Wasserstoffperoxid: Ein Gemisch aus 30% Wasserstoffperoxid und 92% Schwefelsäure wurde aus der Berechnung , hergestellt. Wasserstoffperoxid in Schwefelsäure zaholozhennoy Kühlwasser eingeführt , während die Temperatur von 15 ° C Mischung beibehalten Die molare Konzentration der Schwefelsäure in der Mischung betrug - 8,6 M, die Wasserstoffperoxid - 5 M, das heißt die Mischung einen beträchtlichen molaren Überschuß an Schwefelsäure enthält. Und die resultierende Mischung wurde während 1 Stunde verschiedenen Mengen auf Basis von Wasserstoffperoxid von 5 bis 15 g pro 1 kg Katalysator dosiert. Am Ende der Pulpe auf beiden Behandlungsmöglichkeiten wurden in den Lösungen herausgefiltert wurden von der Konzentration der Schwefelsäure und Platin bestimmt wird, wird verwendet, um die Rückgewinnungsrate und den Anteil der Schwefelsäure zu berechnen. So wird in Lösungen von Kaliumhydroxid in Wasser trap Aktivchlor definiert und berechnet die spezifische Ausbeute an Chlorgas während der Verarbeitung. Die Ergebnisse sind in der Tabelle gezeigt.
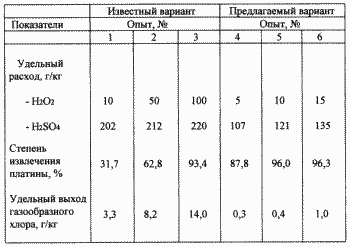
Aus der Tabelle folgt, dass die bekannten Ausführungsform ein hoher Extraktionsgrad von 93,4% Platin , nur wenn der spezifische Verbrauch von Wasserstoffperoxid in 100 g / kg Katalysator und Schwefelsäure 220 g / kg erreicht wird. In diesem spezifischen Ausbeute an Chlorgas betrug 14 g / kg. Gemäß einem Ausführungsbeispiel bereits in dem spezifischen Verbrauch von Wasserstoffperoxid vorgeschlagen - 10 g / kg und Schwefelsäure - 121 g / kg 96% Platin gewonnen und spezifische Ausbeute an Chlorgas betrug nur 0,4 g / kg. Somit reduziert nach dem vorgeschlagenen Variante deutlich Reagenzverbrauch und Umweltsicherheit und die Sauberkeit des Prozesses erhöht.
FORDERUNGEN
Verfahren zur Extraktion von Edelmetallen aus Materialien, welche diese enthalten, wobei die Materialien mit einer Lösung Auslaugen Chloridionen enthält, Einführen von in der Laugungslösung von Schwefelsäure und Wasserstoffperoxid, eine nachfolgende Verarbeitung produktive Lösung mit der Gewinnung von Edelmetallen und Rückführen der verarbeiteten Lösung der Auslaugung, dadurch gekennzeichnet, daß der schwefel H 2 O 2> 1 ist , und Kühlen: Säure und Wasserstoffperoxid in der Laugungslösung als ein Gemisch eingeführt wird, wird das Mischen durch Einleiten von Wasserstoffperoxid zu Schwefelsäure bei einem molaren Verhältnis von H 2 sO 4 durchgeführt.
Druckversion
Erscheinungsdatum 07.11.2006gg




Kommentare
Kommentar nicht vergessen , dass der Inhalt und der Ton Ihrer Nachrichten , die Gefühle von echten Menschen verletzen können, Respekt und Toleranz gegenüber seinen Gesprächspartnern, auch wenn Sie Ihr Verhalten in Bezug auf die Meinungsfreiheit ihre Meinung nicht teilen, und die Anonymität des Internets, ändert sich nicht nur virtuell, sondern realen Welt. Alle Kommentare werden aus dem Index, Spam - Kontrolle versteckt.