Phosphate: Psevdomalahit (Tagil)
Diagnose - Karte.
Cu 5 (PO 4)2 * H 2 O
Kristallsystem monoklin
Härte 4-5
Spezifisches Gewicht 3,8-4,4
Die Spaltung ist schlecht
Bruch muschelig
Farbe grün
Pulver Farbe azur grün
Glanz Glas

Es kommt in Form von Strahlungs soskoobraznyh Massen faser- oder konzentrische gebänderte Struktur, Malachitgrün und schwarz und grün. Es löst sich in Säuren. Es hat Ähnlichkeit mit Malachit. Auch als es Tagil.
Die chemische Zusammensetzung - Gehalt (%) CuO - 66-72; P2O5 - 20-24; H2O- 6,8 - 9,1. Prismatische Art von Symmetrie. Die Spaltung - durch {010} klar. Baugruppen - Einzelne Kristalle sind selten. Prismatic auf [001] normalerweise mit unebenen Kanten und geringe Größe. Kristalle werden oft in subparallel Aggregaten mit drusy Oberfläche oder in der Halbkugel verbunden sind; und nierenförmig, mit einem massiven aciniform oder radial-Faserstruktur und konzentrisch banding; Fasern sind entlang der [010] verlängert; foliose; mikrokristallinem oder dicht; colloformic.
Herkunft.
Verteilt als Sekundärmineral in den Oxidationszonen von Kupfervorkommen in Verbindung mit Malachit gebildet, chrysocolla, Tenorit, Pyromorphit.
Psevdomalahit Cu 5 (PO 4)2 * H 2 O (Wasser enthält Phosphor und Phosphat) unterscheidet sich von Malachit - Cu 2 (CO 3) · (OH) 2 durch die chemische Formel (carbonat). Von selbst, Malachit nicht zu hart, spröde, bricht Aufprall in Stücke, reagiert es auf Salzsäure mit Schnellkoch - ein Sekundärmineral in der Oxidationszone von oberflächennahen Ablagerungen von Kupfererz gebildet. Psevdomalahit (es wird auch als "Hund von Baskerville" und "Belarus") - das Ergebnis der vulkanischen Aktivität im Bereich der Thermalwasser vulkanischen Calderas (Quelle von heißem Thermalwasser, Dampf) und Phosphor enthält. Marshes.
Geburtsort.
Entdeckt in Likasi in der Provinz Shaba (Zaire), Thüringen (Deutschland), in Cornwall (England), Frankreich, Belgien, Pennsylvania (USA) und Australien. Psevdomalahit - Sekundärmineral. Es tritt mit Quarz, Chalzedon, Malachit, Cuprit, chrysocolla, Tenorit, Limonit zusammen. Einlagen: Deutschland (Rheinland, Berge Thüringer Wald in der Nähe von Hof et al.), England (Cornwall), Portugal, sowie große Mengen in Russland (Nischni Tagil, wo der zweite Name des Minerals - Tagil).


Psevdomalahit. Mednorudyanskoe m-tion, Nieder. Tagil, Sr.Ural, Russian (CIS). Foto: © AA Evseev.

Psevdomalahit ( "Elite") - ein bläulich-grünen Streifen in Malachit (Bandmitte).
Mednorudyansky p-k, Nieder. Tagil, Mi. Ural, Russland, GUS-Staaten. Foto: © AA Evseev.
Rund bläulich Pseudomalachit - verglaster Malachitgrün Typ Kimberlit
tektites, Eingabe das Ergebnis in die Lithosphäre Schichten der Erdkruste und Felsen glühend Uran
Meteor und Boliden durch die Bildung von Kimberlitröhren im Boden des Magmas zum Zusammenbruch.
Das Erdbeben, entkommen die Ratte Tiere versteckt, das Meer (Krankheit und Tod), "Apocalypse"
Malachit Cu 2 (CO 3) · (OH) 2
Psevdomalahit Cu 5 (PO 4)2 * H 2 O
Wir reduzieren die Formel für die gleiche Anzahl an Kupferatomen:
Malachite 5 x (Cu 2 (CO 3) · (OH) 2
Psevdomalahit 2 x (Cu 5 (PO 4)2 · (H 2 O)
Lassen Sie uns die Formel für die Anzahl der Atome zu untersuchen:
10 Malachite Cu (C 5 O 15) · 10 H 10 O
Psevdomalahit Cu 10 (P 4 O 16) * H 4 O 2
Malachit Cu 5 O 10 C 25 * H 10
Psevdomalahit Cu 4 O 10 P 18 * H 4 - P hinzugefügt Phosphor
Der Unterschied der Atome - C 5 O 7 * H 6 = 3 x (H 2 O) + 5 × C + O 4 (*)
- Kohlenstoff (diamond) = 3 x (H 2 O) + x 2 (CO 2) + C 3 (**)
- Kohlenstoff (schwarzer Diamant) = 3 x (H 2 O) + 2 x (CO) + (CO 2) + C 2 (***)
- Eine Kombination von Atomen ( "CO") = 5 x (CO) + O 2 + 3 x H 2 (****, "Gas")
- Eine Kombination von Atomen ( "CO") = 5 x (CO) + 2 x (HO 2) + H 2 (****, "Wasser")
(*) Anmerkung. Es ist eine lange Zeit in der Gegenwart von zusätzlichen physikalischen und chemischen Kombination von Sauerstoff O 4 (Fuller) Atome. Zersetzt bis O 4 -> 2 x O 2 (Sauerstoff) oder freiem Sauerstoff und Ozon, mit Blitzeinschlägen: O 4 -> O (Atom geht an der Grenze der Atmosphäre, Ozon) + O 3 (freies Ozon reichert sich an der Oberfläche Boden, schwer). Carbon - Fullerenen C 5 - shungite in Karelien (CIS), behandelt werden - liefert Sauerstoff (furely etc.). Best resort Sauerstoff (Karelien, die Russische Föderation (GUS) - sind im Norden von Europa, der Russischen Föderation (GUS), Peter I) behandelt.
(**) Hinweis. Das attraktivste, diamondiferous Kimberlit Rohr ( "Big Pit" Kimberley in Südafrika, "Frieden", "erfolgreich" in Russland (GUS), "InGOK" in der Ukraine, GUS) - mit schwarzen freien Gas Kohlenstoff C gebildet, grau Flüssigkeit Graphit C 2 ( bound) und der weiße Feststoff Diamant C 3 oder carbonado (eine Mischung aus Kohlenstoff in dem Kristall). Reaktivität Kimberlitröhren - die Inhalation von Kohlenstoff C -> CO -> CO2 (Dyspnoe, Anämie, Sauerstoff zu verbrauchen in Hämoglobin), ätzende Graphit (Geschwüre) und Tod (almazifikatsiya Körper Kristalle, Silikose). Wasserquellen, geben Sie "Mirgorod", weiß (es ist unmöglich zu trinken - eine Alternative zum Trinken zu haben).
(***) Hinweis. Die giftige auch in kleinen Dosen von Kohlenmonoxid CO und Kohlenstoff C Vergiftung (Synkope). Vergiftung mit Kohlendioxid CO 2 - Kohlendioxid Zaun für Industrie (Soda, "Soda", "American - Syndrom", wie "Kislowodsk", Selters, Russland, GUS).
(****) Hinweis. Die Kombination von Atomen C 5 * O 7 * H 6. Kohlenmonoxid CO und Wasserstoff mit Sauerstoff, schwierig, eine gefährliche Kombination zu diagnostizieren. Es gibt einen "trockenen" und "nassen" (Wasser, Dampf, Caldera). Wenn die Ausgänge der trockenen Vulkan Haji gesammelt Wasserstoff und Sauerstoff (trockene Caldera). Der zweite Typ - Mineralwasser (Wasserstoff verlässt durch Kochen) in Flüssen und Bächen Berge Quellen.
- Wasserstoff ( "bomb") = 5 x (CO) + 2 x (H 2 O) + H 2 (*****)
(*****) Hinweis. Durch den Hub von radioaktivem Uran, usw. (Auto) Atom- und Kernreaktion und erzeugte Wasserstoffgas - Isotop H 1 und seltene Isotope gehen - Deuterium H 2 und Tritium, H 3 sowie Atom- und Kern Derivate - flüssiges Helium He 2 (Deuterium H 2) und Li Li 3 (ab 3 H Tritium). Radiation oberflächliche Läsionen aktiv Kern Isotop H 1 Wasserstoff (Haut - Neutronen 0) Fusion brennt Er 2 (Muskeln, Weichgewebe, moderate - Proton +) und die Niederlage von Li 3 (Verkohlung und "uglifikatsiya" Körper, extrem schwere Verletzungen und Verbrennungen, "Körper brennt", Tod, totale Niederlage der Strahlung - das Elektron -).
Wir fassen Formel für die Anzahl der Atome:
10 Malachite Cu (C 5 O 15) · 10 H 10 O
Psevdomalahit Cu 10 (P 4 O 16) * H 4 O 2
Malachit Cu 5 (C 2 O 7) * O 5 H 5 |
Psevdomalahit Cu 10 (P 4 O 16) * H 4 O 2 | Bild oben (Malachit + psevdomalahit)
Malachit Cu 5 (C 3 O 8) * O 5 H 5 |
Die Menge der Atome - Cu 20 C 5 P 4 O 43 H 14 => Cu + P 204 (Belarusian Typ)
Hinweis. Die Kauens und Kimberlit Mineralien in der Zone der aktiven Drehung des Kimberlit-Rohr (Tornado im Boden). Gebildet gediegenem Kupfer ( "Fingerabdruck Salze"), 99,3% in der höchstmöglichen Menge an Rückgewinnung von Kupfer Metall (Russland, GUS) und der mechanischen Entfernung von Phosphor Fuller getrennt, chemisch aktive - Sümpfen von Belarus, Europa, GUS. Kimberlit Trennung - schnelle mechanische Drehung Kimberlit Rohr (Tornados im Boden) eine nahezu vollständige Trennung von Mineralien (Russland, GUS). Mechanische Heizung - Heizwärme (calcine).
Chemische Reduktionsreaktion von Kupfersalzen und Trennung von Phosphor in Gegenwart von N Stickstoff ist der Katalysator, der in der chemischen Reaktion in der letzten Prozess nicht verwendet wird, und tritt in sekundäre chemische Reaktionen mit den übrigen Umgebung. Magma Gas N 2 (Kernreaktionen im Inneren des Erdkerns). Atomsfere hohen Gehalt an chemisch inert. Zusätzlich wird das Gas Cyanid freigesetzt - giftig, gebildet Cyanide - toxische Verbindungen. Farblos, giftiges Gas mit einem bitteren Geruch , bestehend aus Stickstoff und Kohlenstoff Cyano (CN) 2. Beispiel toxischer Verbindungen durch im Zusammenhang mit magmatische Caldera - Kaliumcyanid KCN, Natriumcyanid NaCN (Natrium-Kühlmittel Tankstelle Kernreaktor). Basierend Stickstoff N.
Balancieren Atome - - C 5 - O 43 H 14 => C 5 * O * H 4314 (Kimberlit Rotation)
Katalysator - N + N 2+ N n (frei Stickstoffdioxid, Stickstoff Fuller)
Malachit - (C 2 O 7) * O 5 H 5 |
Psevdomalahit - (- O 16) * H 4 O 2 | Cyano (CN) 2
Malachite - (C 3 O 8) * O 5 H 5 |
Kernreaktion 92 U (Uran) -> N 7 (Stickstoff) x 85 + (85 Einheiten des Periodensystems.)
Kernreaktion 236 U (Uran) -> N 14 (Stickstoff) x 222 + (222 atomaren Masseneinheiten.)
U dauert 2 O Sauerstoffatom und Formen Uraninit UO 2, UO Pechblende 2 * n (H 2 O)
Nicht beständig thermische Uran U 3 O 8 ist auch gefährlich, kann nicht atmen (sauerstoffverbrauchenden ) 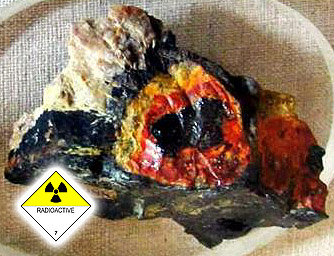 Beispiel Nähe Kimberlit Rohr der dritten Art - Uraninit, Gummis für Uraninit (Nordkarelien, der Russischen Föderation, der europäische Teil Russlands, der GUS). Er wirft auf der Oberfläche des Kimberlit-Rohr - wie irdenen Tornados (Tornado, ein Blutgerinnsel). Uranvorkommen - Volodarsk Pegmatiten Volyn, Region Schytomyr. Westukraine (GUS) und der Lugansk Region der Ukraine (GUS), Krim (GUS). Economy ist mit dem "Capital" gewidmet (Marx).
Beispiel Nähe Kimberlit Rohr der dritten Art - Uraninit, Gummis für Uraninit (Nordkarelien, der Russischen Föderation, der europäische Teil Russlands, der GUS). Er wirft auf der Oberfläche des Kimberlit-Rohr - wie irdenen Tornados (Tornado, ein Blutgerinnsel). Uranvorkommen - Volodarsk Pegmatiten Volyn, Region Schytomyr. Westukraine (GUS) und der Lugansk Region der Ukraine (GUS), Krim (GUS). Economy ist mit dem "Capital" gewidmet (Marx).
Es - Kimberlitröhren, in denen es eine aktive Kernreaktion ist und tiefer in den Körper verjüngt wie Karotten Körper Kimberlit (Kimberlit), die höhere Radioaktivität Kimberlit. Scary Treibgas aus dem Kimberlit Rohrkörper (die so genannte "Laser"). "Die Welt" (Jakutien, Russland, GUS).
Auf dem Foto - komplett Pseudomorphose bunten Turmalin elbaite (Formular). Es scheint elbaitopodobny Dravya schorl (Turmalin), müssen aber ein Dosimeter. Von 18 mR / h - Stopp von 24 mR / h - kurzfristige Aufenthalte von 32 mR / h - ab. Von 100 mR / h - der Tod. Berühmte Kimberlit Minen und Uranminen. Ein Beispiel für die Freisetzung von Radioaktivität - pos. Novogorny (Russland, GUS), 1987-1989 g, 2 Roentgen / Stunde.
Merkmale kimberlites beschriebenen Typen (zB Uran-Malachit-psevdomalahitovogo Typ mit einer aktiven Freisetzung der Caldera) - schwer zu atmen, nicht genug Sauerstoff für die Atmung, Kohlenstoff-Vergiftung, Kohlenmonoxid und Kohlendioxid, Sauerstoff-Vergiftung (reines Gift) und Wasserstoff-Stickstoff-Problem atomsfery. Fallen Ebenen atomsfery Kimberlit, die horst Struktur und lassen Sie die Trichter Rotation Kimberlit im Land (und die Grube im Raum, Stratosphäre), Gas aus dem Boden in die "Laser" ( "Strahl") Typ bläst, ist unsichtbar. Die Radioaktivität.
Wasserstoff, H (lat hydrogenium und Wasserstoff; n Wasserstoff; f hydrogene; ..... Und Hidrogeno), - ein chemisches Element im Periodensystem der Elemente des Mendelejew, die gehören sowohl die I und VII Gruppen, Ordnungszahl 1, Atomgewicht 1, 0079. Die Natur hat eine Wasserstoff stabilen Isotopen - protium oder Wasserstoff (1 H, 1 H), um das Risiko von Kern Deuterium (2 H, H 2 oder D) und dem bekannten radioaktiven teromoyaderny - Tritium (3 H, 3 H oder T). Bei natürlichen Produkten der Erde durchschnittliche Verhältnis von D / H = (158 ± 2) 06.10 * Der Gleichgewichtsgehalt von 3H in der Welt ~ 5 * 1027 Atome.
Wasserstoff wurde zum ersten Mal im Jahre 1766 durch Wissenschaftler G. Cavendish beschrieben. Unter normalen Bedingungen Wasserstoff - Gas ist farblos, geruchlos und geschmacklos. In der Natur, im freien Zustand ist es in Form von H2-Molekülen. Die Dissoziationsenergie des Moleküls H2 - 4776 eV; das Ionisierungspotential des Wasserstoffatoms 13,595 eV. Wasserstoff - das leichteste aller bekannten Substanz, Dichte bei 0 o C und 0,1 MPa 0,0899 kg / m3; t kipeniya- 252,6 o C, t Schmelz - 259,1 o C; Kritische Parameter: T - 240 o C, der Druck 1,28 MPa, eine Dichte von 31,2 kg / m3. Die meisten aller wärmeleitenden Gas - 0,174 W / (m * K) bei 0 ° C und 1 MPa, die spezifische Wärme 103 J * 14,208 (kg * K).
Flüssiger Wasserstoff ist sehr leicht (Dichte bei -253 ° C 70,8 kg / m3) und Flüssigkeit (Viskosität bei -253 ° C beträgt 13,8 cps). In vielen Wasserstoffverbindungen besitzt einen Oxidationszustand +1 (wie Alkalimetalle), mindestens 1 (ähnlich Metallhydride). Unter normalen Bedingungen molekularem Wasserstoff maloaktiven; Löslichkeit in Wasser bei 20 o C und 1 MPa 0,0182 ml / g; leicht löslich in Metalle - Ni, Pt, Pd, usw. , mit Sauerstoff zu 143,3 MJ / kg (bei 25 o C und 0,1 MPa) Wasser unter Freisetzung von Wärme zu bilden .; bei 550 o C und obige Reaktion wird durch eine Explosion begleitet. Wenn mit Fluor- und Chlorreaktionen in Wechselwirkung treten mit einer Explosion. Grundwasserstoffverbindung Wasser H2O, Ammoniak NH3, Schwefelwasserstoff H2S, Methan CH4, Metallhydride und Halogen CaH 2, HBr, HCl, C2H4 organische Verbindungen, HCHO, CH3OH und andere Wachse.
Wasserstoff - ein gemeinsames Element in der Natur, dessen Inhalt in der Kruste 1% der Erde (nach Gewicht). Der Hauptwasserstofftank in der Welt - die hydrosphere Wasser (11,19 Gewichts-%). Wasserstoff - eine der wichtigsten Komponenten der natürlichen organischen Verbindungen. In freiem Zustand ist in vulkanischen und andere natürliche Gase in der Atmosphäre (0,0001% der Anzahl der Atome). Machen Sie den Großteil der Masse der Sonne, Sterne auf, interstellarem Gas, Gasnebeln. In den Atmosphären der Planeten in Form von H2, CH4, NH3, H2O, CH, NHOH und andere. Es ist ein Teil der Korpuskularstrahlung der Sonne (Protonenflüsse) und die kosmische Strahlung (Elektronenfluss).
Rohstoffe für die industrielle Produktion von Wasserstoff - kimberlites, Raffineriegase, Erdgas, Kohlevergasung Produkte und andere Verfahren zur Herstellung von Wasserstoff :. Kohlenwasserstoffdampf-Reaktion, partielle Oxidation von Kohlenwasserstoffen mit Sauerstoff, die Umwandlung von Kohlenmonoxid, Wasserelektrolyse. Wasserstoff wird für die Herstellung von Ammoniak, Alkohol, synthetisches Benzin, Salzsäure, Hydrotreating Erdöl Schneiden von Metall-Wasserstoff-Sauerstoff-Flamme verwendet. Wasserstoff - eine vielversprechende gasförmigem Brennstoff (NASA). Deuterium und Tritium wurden im Kernkraftwerk (KKW) verwendet. Nach den Materialien: http://www.mining-enc.ru
 Wasser (und Wasser, Herr Wasser; f eau; .... Und agua) - gemeinsam in der Natur ist einfach, stabil unter normalen Bedingungen, anhaltende chemische Verbindung von Wasserstoff und Sauerstoff, H 2 O (11,19% Wasserstoff und 88,81% Sauerstoff, für Gewicht); farblose Flüssigkeit (in dicken Schichten - bläuliche Farbe der vodroda, die Wirkung der Wolga, der Russischen Föderation (GUS) und grüner Farbe -. das Meer, Kupfer und Gold), geruchs- und geschmacksneutral. Brown - Bitumen (der Fluss Don.). Wasser hat eine entscheidende Rolle in der geologischen Geschichte der Erde und den Ursprung des Lebens, in der Bildung der physikalischen und chemischen Umwelt, Klima und Wetter. Wasser - ein unverzichtbarer Bestandteil nahezu aller Produktionsprozesse (Hydraulik, seit 1969 - in den kimberlites).
Wasser (und Wasser, Herr Wasser; f eau; .... Und agua) - gemeinsam in der Natur ist einfach, stabil unter normalen Bedingungen, anhaltende chemische Verbindung von Wasserstoff und Sauerstoff, H 2 O (11,19% Wasserstoff und 88,81% Sauerstoff, für Gewicht); farblose Flüssigkeit (in dicken Schichten - bläuliche Farbe der vodroda, die Wirkung der Wolga, der Russischen Föderation (GUS) und grüner Farbe -. das Meer, Kupfer und Gold), geruchs- und geschmacksneutral. Brown - Bitumen (der Fluss Don.). Wasser hat eine entscheidende Rolle in der geologischen Geschichte der Erde und den Ursprung des Lebens, in der Bildung der physikalischen und chemischen Umwelt, Klima und Wetter. Wasser - ein unverzichtbarer Bestandteil nahezu aller Produktionsprozesse (Hydraulik, seit 1969 - in den kimberlites).
Die Isotopenzusammensetzung des Wassers. Aufgrund der Existenz von zwei stabilen Isotope von Wasserstoff 1H (H 1) und 2 H, D (H 2) von H und D (Deuterium) und drei von dem Sauerstoff (16O, 17O und 18O) bekannt 9 Isotop Sorten von Wasser in der Regel bezeichnet. Von besonderem Interesse ist das schwere Wasser D2O. Die physikalischen Eigenschaften von Wasser und ihrer Anomalien durch die Tatsache definiert ist, daß seine Moleküle in Komplexen mit Wasserstoffbrückenbindungen kombiniert (kimberlite und Uran iinogo Typ). Es gibt eine Reihe von hypothetischen Strukturmodelle von Wasser erfordern weitere Klärung.
Die Struktur des Wassers ist nicht nachhaltig unterschiedlicher Natur, weil Wasserstoff - Bindung ist etwa 10 - mal stärker als die üblichen intermolekulare Wechselwirkung (der Winkel zwischen chemischen Bindungen 104 o 27 ') - können Kohlenstoffatome C und sporadische Bildung von organischen Verbindungen kommen. Die Struktur des Wassers hängt von der Art und der Konzentration der Verunreinigungen, die in es in einem ionischen, molekularen und fulernoy (bulk, setchatoobraznoy) bildet. Verschiedene Ionen, Moleküle gelöster Gase kann die Struktur des Wassers zu ändern, beispielsweise kleine Heliumatome und Wasserstoffmoleküle können, ohne zu brechen Wasserstoffbindungen und anderen Verbindungen in der chemischen Struktur von Wasser gelegt werden.
Die Elektronendichteverteilung in dem Wassermolekül ist, so daß 4-polig ist kostenfrei 2 positive Wasserstoffatomen verbunden ist, und 2 negativ bezogen Wolken der nicht-vergesellschafteten Paare von Elektronen des Sauerstoffatoms an Elektrons. Diese Gebühren Pol an den Ecken eines Tetraeders angeordnet. Infolge dieser Polarität hat ein Dipolmoment von Wasser (1,86 D). Die Kristallstruktur von gewöhnlichen Eis hexagonal, "lose" (Wasserstoff), gibt es viele "Lücken" sind (mit einem dichten "Verpackung" von Wassermolekülen in Eiskristalle, war seine Dichte über 1600 kg / m3). In flüssigem Wasser Eis inhärente Verbindung jedes Molekül H2O mit vier benachbarten ( "Nachbar-Prozedur") weitgehend erhalten bleibt; aber "Lockerheit" der Struktur verringert das Schmelzen von Eis, Moleküle "Fernordnung" fallen in die "Lücken", die in der Dichte von Wasser führt zu einer Erhöhung.
Viele physikalische Eigenschaften von gewöhnlichem Wasser (Lösung) zeigen signifikante Anomalien. Wasser erreicht seine maximale Dichte von 1000 kg / m3 bei +3,98 o C; weitere Abkühlung nimmt abrupt abnimmt und beim Gefrieren (Wasserstoff vorhanden kimberlite - Katalysatoren, die Bildung von Dendriten der festen Lösungen und der losen Masse), während die Kristallisation verbleibenden Substanzen durch eine Erhöhung der Dichte begleitet (ohne Additive).
Wasser ist in der Lage signifikante Hypothermie, d.h. kann unterhalb der Schmelztemperatur in dem flüssigen Zustand bleiben (auch -30 o C) - ohne Beimischungen destilliert Fremdkeim germ. Die Viskosität von Wasser mit zunehmendem Druck abnimmt und nicht wie andere Flüssigkeiten erhöhen. Die Kompressibilität des Wassers ist sehr gering und nimmt mit steigender Temperatur ab. Einige Anomalien geschwächt wie Salzgehalt des Wassers und auch in gesättigten Lösungen verschwinden. Eigenschaften von Wasser kann beträchtlich in Abhängigkeit von den natürlichen Bedingungen variieren in der Natur vorkommenden oder künstlich erzeugt (die Wirkung von Temperatur und Druck, Magnetfeldern).
Chemische Eigenschaften von Wasser unter normalen Bedingungen. Wasser - genug , um stabile Verbindung, die Zersetzung von Molekülen H2O spürbar wird nur über 1500 o C Wasser mit einer Reihe von basischen und sauren Oxiden in Wechselwirkung tritt, bilden jeweils eine Basis und Säure. Verbinden von Wasser zu Molekülen von ungesättigten Kohlenwasserstoffen liegt unter dem industriellen Verfahren zur Herstellung von Alkoholen, Aldehyden, Ketonen. Wasser wird in vielen chemischen Prozessen als Katalysatoren beteiligt. Somit Umsetzung von Alkalimetall mit Wasserstoff oder Halogen, die meisten Oxidationsreaktionen gehen nicht auf die Abwesenheit von sogar Spuren von Wasser.
(Kimberlit Wasserstoff, Helium und andere Komponenten) Gase ist gut in Wasser löslich, wenn es in chemische Wechselwirkung treten können (Ammoniak, Schwefelwasserstoff, Schwefeldioxid, Kohlendioxid). Andere Gase sind weniger löslich in Wasser. Mit abnehmendem Druck und steigender Temperatur (80 ° C) , um die Löslichkeit des Gases in Wasser reduziert wird . Viele Gase bei niedrigen Temperaturen und steigenden Druck nicht nur in Wasser zu lösen, aber auch kristalline Hydrate zu bilden.
Wasser - ein schwacher Elektrolyt (Lithium, etc.), aus der Gleichung Dissoziieren H2O <=> H + + OH & supmin; und die quantitative Charakteristik der elektrolytischen Dissoziation von Wasser das Ionenprodukt von Wasser: Kw = [H +] [OH & supmin;], wobei [N +] und [OH & supmin;] - Ionenkonzentration in den jeweiligen g-Ionen / l; Ap 10-14 (22 ° C) und 72 * 10-14 (100єS). Wasser löst viele Säuren, Basen, Mineralsalze. Solche Lösungen leiten Strom aufgrund der Dissoziation der gelösten Stoffe hydratisierten Ionen zu bilden.
Viele Substanzen, wenn sie in Wasser kommen in ihre Doppelzersetzungsreaktion genannt Hydrolyse gelöst. Organische Substanzen in Wasser gelöst sind diejenigen, die polare Gruppen enthalten (-OH, -NH 2, -COOH, etc.) und haben nicht zu hohes Molekulargewicht. Das Wasser selbst ist sehr gut löslich (oder mischbar in allen Punkten) in einer begrenzten Anzahl von organischen Lösungsmitteln. Jedoch eine vernachlässigbare Verunreinigungen zu den organischen Substanzen ist das Wasser fast immer vorhanden und können dramatisch die physikalischen Konstanten des letzteren zu ändern. Die Natur des Wassers in Form von Lösungen gefunden.
Wasser in der Natur. Natürliches Wasser ist eine Art von Mineral, durch instabile chemische Zusammensetzung gekennzeichnet, die Anwesenheit verschiedener Verunreinigungen, ändert sich seine Eigenschaften und das ist die Aufgabe der Produktion, Verarbeitung und Verwendung in großen Mengen (ca. 3 1012 m3 / Jahr). Ozeane, Meere, Seen, Stauseen, Flüsse, Grundwasser, Bodenfeuchte bilden die Schale des Wassers (Hydro-). In einer Atmosphäre von Wasser in Form von Dampf, Nebel und Wolken, regen und Schneekristalle.
Im Permafrost, Süß- und Brack unterirdisch Gravitations Wasser in Form von gemahlenem Eis, das Vorhandensein von Permafrost zu bestimmen. Boden Eis im Permafrost (vor allem in verteilten) verändern ihre physikalischen Eigenschaften (mechanische Festigkeit erhöht drastisch die Wasserdurchlässigkeit zu verringern, etc.). Salty Grundwasser und Solen in Permafrost negative Temperaturen und Vibrationen während der Veränderungen in der Zusammensetzung erfahren.
Die Erdkruste enthält, nach verschiedenen Schätzungen zwischen 1 und 1,3 Milliarden Euro. Km3 Wasser. An den gleichen Reserven von frischem (Brack) Wasser sind eher begrenzt, und Salzwasser - Quellen von Mineral Halit (NaCl - Kochsalz) Typ Komponenten etc .. Eine erhebliche Menge an Wasser in der Erdkruste ist in einem gebundenen Zustand, wobei ein Teil von einigen der Mineralien und Bergbau Art (Gips, hydratisierte Formen von Siliciumdioxid, Silicat und andere.). Ein umfangreiches Angebot an Mena Volumen von Gesteinen und Mineralien (Wasser in der Wüste, etc.).
Konstitutionellen (H2O <=> (OH-) + (H +)) Wasser im Kristallgitter in Form von Mineralien OH- Ionen, zumindest - H +, d.h. die Zerstörung des Kristallgitters jedes mineral - durch mechanische und andere (Ion und Strahlungs chemische, elektrische) hergestellt. Kristallwasser hat einen festen Platz in der Gitterstruktur des Minerals in Form von H2O-Moleküle. Ein Teil des Kristallwasser freigesetzt, ohne das Gitter zerstört und absorbiert Mineral Veränderungen der äußeren Bedingungen (Heizung-Kühlung) genannt Zeolith. Adsorption von Wassermolekülen an der Oberfläche der Mineralkristalle gebunden eine hygroskopische Schicht (interplanaren Mineralien in den Schichten der Schichtstruktur enthalten sind) zu bilden. In erheblichen Mengen Adsorption Wasser in den festen Kolloide (Opal et al.). Wasser füllt die dünnen Röhrchen in Boden, Fels, bekannt als hygroskopisch (Kapillare). Unterscheiden freies Wasser füllt die Hohlräume, Risse und beweglich unter der Wirkung der Schwerkraft, die Heizung Batholithen, mechanische und Strahlenchemie Kimberlit et al.
Große Mengen an Wasser (13-15 Milliarden Euro. Km3) sind in den Erdmantel (die Freisetzung von Magma durch die Caldera) konzentriert. Wasser, das in den Prozess der inneren Erwärmung der Erde in den frühen Stadien ihrer Entwicklung, nach modernen Ansichten aus dem Mantel verdampft, bildete die hydrosphere. Der jährliche Wasserstrom aus dem Mantel und Magmakammern etwa 1 km3 (juvenile Wasser). Es gibt Anzeichen dafür, dass das Wasser, zumindest teilweise, kosmischen Ursprungs (Sonne-Emissionen, Planeten, Supernovae und Quasaren): Protonen, die in die obere Atmosphäre der Sonne kam und andere Stars, die Erfassung Elektronen wiederum in Atome Wasserstoff, die mit vereint Sauerstoffatome erzeugen Wasser. Alle Gewässer der Erde sind miteinander sowie mit der Atmosphäre, Lithosphäre, Biosphäre und ständig interagieren. Wasser - ein aktiver Faktor von endogenen und exogenen geologischen Prozesse und Wasser sind eng verwandte Prozesse der Bildung von Ablagerungen und Mineralisierung.
Unter natürlichen Bedingungen variieren in Abhängigkeit der quantitative Zusammensetzung der Verunreinigungen auf die Herkunft des Wassers und geologischen Bedingungen. Wenn die Salzkonzentration bis zu 1 g / kg Frischwasser berücksichtigt wird, bis zu 25 g / kg - Brack, oben - Salz. Die am wenigsten mineralisierten Wasser ist Niederschlag (im Durchschnitt etwa 10 bis 20 mg / kg), gefolgt von Süßwasserseen und Flüssen (50-1000 mg / kg) - obwohl es salzig sind. In Kharkiv, Ukraine war die GUS ein Sommer regen salzig - 2010 (Wasser Tornado). Der Salzgehalt des Meeres liegt bei etwa 35 g / kg; Viele Meer haben niedrigere Salinität (Schwarzes Meer - 17-22 g / kg, einem Nebenfluss des Don Flusswasser, Ostsee -. Newa Wasserstrom, 8-16 g / kg, das Kaspische Meer -. Wasserfluss p Wolf 11-13 g. / kg - nach Art Wasserfall Mitchell Wasserfall Kimberlit-Komplex mit Pater).
Mineralisation des Grundwassers in der Nähe der Oberfläche im Falle einer übermäßigen Feuchtigkeit bis zu 1 g / kg, in den trockenen Bedingungen von bis zu 100 g / kg; artesischen Becken im tiefen Wasser Salinität ist sehr unterschiedlich. Maximale beobachtete Konzentration von Salzen in Salzseen (bis zu 300 g / kg) und von Tiefenwasser (bis zu 600 g / kg). In Süßwasser vorherrschen HCO3-Ionen, Ca2 + und Mg2 +. Der Gehalt in Wasser Ionen Ca2 + und Mg2 + bestimmt seine Steifigkeit. Wie die TDS-Konzentration steigt Ionen SO42-, Cl-, Na + und K +. Die stark mineralisierte Wasser (Mirgorod, Gebiet Poltawa., Ukraine, GUS und andere.) Vorherrschend Ionen Cl- und Na +, Mg2 + und weniger seltene Ca2 +. Andere Elemente in sehr geringen Mengen, obwohl fast alle natürlichen Elemente des Periodensystems in der natürlichen Mineralwässer Kimberlit gefunden.
Die primäre Quelle von Salzen in natürlichen Gewässern sind Substanzen, die durch chemische Verwitterung von magmatischen Gesteinen (Ca2 +, Mg2 +, Na +, K + und andere.) Und in der Geschichte der Erde aus dem Boden (CO2, SO2, HCl, NH3, etc.) entwickelt. Aus der Vielfalt der Zusammensetzung dieser Stoffe und die Bedingungen, unter denen ihre Wechselwirkung mit Wasser war, es hängt von der Zusammensetzung des Wassers, die auf einer Studie von hydro-geochemische Prospektion von Mineralvorkommen basieren. Von großer Bedeutung für die Zusammensetzung des Wassers und die Auswirkungen von lebenden Organismen.
Aufgrund der gelösten Gase, die in natürlichen Gewässern, Stickstoff, Sauerstoff, Kohlendioxid, Edelgase, Schwefelwasserstoff und Kohlenwasserstoffe. Grundwasser Gassättigung ändert sich von n * n * 10 bis 103 cm3 / Liter. Die Menge an gelöstem Gas wird der Druck oder Partialdruck des Gases in dem Gasgemisch direkt proportional. Bei Temperaturen bis zu 100 ° C gibt es eine inverse Beziehung Löslichkeit von Gasen in Wasser bei einer Temperatur von über 100 o C Linie. Gassättigungs Wasser hängt auch von dem Salzgehalt, erhöhte die die Löslichkeit von Gasen reduziert. Die am häufigsten verwendeten Gase im Grundwasser gelöst sind CO2, N2, CH4. Weniger und kleinere Mengen an gelöstem O2, H2S, H2, schwere Kohlenwasserstoffe, Edelgase, etc. Es ist eine zonale Verteilung von Gasen in den Untergrund hydrosphere vertikal (abwärts) O2 N2 N2 H2S - CO2 - CH4 - N2 CH4 - N2 (oder N2. - CH4) CH4 - CO2 - CH4 H2S - CO2 - CH4 (in der Reihenfolge der Häufigkeit).
Die Konzentration der organischen Substanzen ist gering - im Durchschnitt Flüsse etwa 20 mg / l im Meer etwa 4 mg / L. Die Ausnahme ist das Wasser der Sumpf und Ölfelder und Wasser von Industrie- und Haushaltsabwasser verunreinigt ist, wo ihre Zahl höher ist. Die qualitative Zusammensetzung der organischen Substanz ist sehr vielfältig und enthält eine Vielzahl von Produkten der Lebenstätigkeit von Organismen im Wasser leben, und Verbindungen, die durch den Zerfall der Trümmer gebildet.
In den Studien der Regelmäßigkeiten der Bildung und Verteilung von natürlichen Gewässern, Beurteilung der Möglichkeiten ihrer Nutzung (Trink-, wirtschaftlichen, technischen, industriellen, Bewässerung, Balneologie und andere. Zwecke), Hydro-geochemischen Suche von Feldern (Öl, Gas, Basismetalle, Br, I, B, und so weiter. d.) ihre Analyse. Das Wasser wird bestimmt: physikalischen und organoleptischen Eigenschaften (Temperatur, Farbe, Geschmack, Geruch, Trübung, Transparenz, Dichte, elektrische Leitfähigkeit); Gelöste Mineral, organisch, radioaktive Stoffe, freie Gase; verschiedene Parameter (pH, Eh, Härte, Oxidation usw. und Aggressivität.); Isotopen und mikrobiologische Zusammensetzung. Typanalyse und Forschungsmethoden definiert sind Zweck und die erforderliche Genauigkeit. Bei der Suche nach Erzen hydroMikroKomponenten (Cu, Pb, Sn, Ag, Mo, Be, Rb, Cs, Mn, Zn, etc.) zu bestimmen; und Studien auf der Suche nach Öl - organische Substanzen (Säuren, aromatische Kohlenwasserstoffe, Phenole, etc.), die Gase Indikator Mikroflora; Die Studie des Mineralwassers - spezifischen Komponenten (As, Br, I, Fe, und andere organische Substanzen.) Gaszusammensetzung (CO2, H2S, H2, O2, Rn, N2, CH4); während für Wasserforschung, Gesundheitskontrolle von Wasser - umweltschädliche und giftige (Pb, As, Se, Sr, etc.) Substanzen, bakteriologische Indikatoren. Bei der Beurteilung der technischen Eigenschaften des Wassers - obestsvechivaemost, Koagulabilität, korrosive Eigenschaften, Filtrierbarkeit.
Das Wasser wurde durch analytische Chemie analysiert: titrimetrisch und instrumental (Kolorimetrie, Photometrie Flamme, Photokolorimeter, Spektrophotometrie, Potentiometrie, Radiometrie, Chromatographie, etc.). Bakteriologische Tests durch Methoden der direkten Berechnung auf Membranfiltern aus, und andere. Um ein Höchstmaß an Sicherheit des Wassergehalts in der Analyse durch die Auswahlregeln, Vorverarbeitung und Konservierung (Versauerung, chloroformization, Kühlung, etc.) Proben entwickelt, um sicherzustellen. Begrenzen der Haltbarkeit von Wasserproben vor der Analyse. Für die Analyse von Wasser mit niedrigem Gehalt der verwendeten Komponenten Konzentration, Extraktion und andere.
Die Verwendung von Wasser. Sie können kein anderes angeben, die so vielfältig und breite Anwendung wäre. Wasser -. Chemischen Reaktanten, die an der Herstellung von Sauerstoff, Wasserstoff, Alkalien, Säuren, Alkohole, Aldehyde, Kalkhydrat nimmt usw. Wasser als Verfahren zur siedenden Komponente, Auflösung, Verdünnung, Auslaugung, Kristallisation usw. verwendet wird, Wasser wird in zahlreichen industriellen Prozessen eingesetzt. In der Technik dient Wasser als Energiequelle (Wasserkraft), Kühlmittel (Heizen, Kühlen), das Arbeitsfluid (Dampfmaschinen). Natürliche Wassernutzung für Trink- und Haushaltswasserversorgung, Wärme (Thermalwasser) in Spa-Behandlung (Mineralwasser), für die Gewinnung der wertvollen Inhaltsstoffe (Sole), usw. Bei der Herstellung von Bergbaubetrieben Wasser wird für den Transport von Gesteinen und Mineralien im Bergbau und Gewinnung von Steinen (hydraulischen Transport), für die Übertragung von Druck und Leistung beim Bohren Bohrlochmotoren sowie für Waschbrunnen und andere. Bei der Entwicklung von überschwemmten Mineralvorkommen umfassend die Fragen und Probleme des Gewässerschutzes verwendet Bergbau, Entwässerung, Entwässerung, Schwall, Entwässerung, Schutz des Gerätes vor der korrosiven Wirkung von Wasser und Wassernutzung (zB für hydraulische Steinbrech, hydraulische Verstauen, Staubkontrolle, Verschlammung, Brandschutz- Maßnahmen, Überschwemmungen Ölfelder). Mit der Verwendung von Wasser durchgeführt, Mineralverarbeitung, Sortieren usw.
Ändern der Eigenschaften von Wasser (magnetische Behandlung - Entfernen der Magnete ferrometallicheskih, halb bio, bio und ansonsten auf das Magnetfeld von Verunreinigungen reagieren) verwendet wird, um die Flotation, Reinigung von Wasser aus Schlämmen von vielen Arten, usw. Als Ergebnis der industriellen Nutzung von Wasser zu verbessern, ist notwendig, um Wasser-Zirkulationssysteme, Entwässerungstechnik einzuführen. und Wasserreinigung. Durch Fallenlassen wird das Abwasser in natürliche Gewässer Reinigung an die Standards der maximal zulässigen Konzentrationen von gelösten Stoffen durchgeführt und in die Hydrosphäre Schutz durchgeführt, Grundwasserschutz (siehe. Sauberes Wasser). In den GUS-Wasseraufnahme basiert auf Wassergesetzgebung und den GUS-Staaten des Commonwealth geregelt. Es gibt auch internationale Abkommen über den Schutz der Wasserressourcen im RGW und anderen zwischenstaatlichen Organisationen. Nach den Materialien: http://www.mining-enc.ru
- Gatchell - "New Almadén snag" - Arsenid und Antimonsulfid (moderne Sulfosalze)
- Antimon - giftiges Metall (Halbmetall) sind in der Industrie, Medizin und Technik weit verbreitet
- Zirconium - eine seltene und nicht - Metall und gefährliche Juwel in der Oxid und Salzen
- Gold - gelb gefährlichen und giftigen Metall -date und genaue digitale Kabeltechnik
- Schwefel - eine goldgelbe toxische Substanz und ein Zeichen der vulkanischen Aktivität
- Cadmium - ein giftiges unz unbekannt breites Spektrum von Menschen silbriges Metall
- Blei - ein giftiges grau Simulator Silbermetall und giftiges Metall snag
- Arsen - Gift klassischen mittelalterlichen und modernen Vergiftern und Medizin in der Medizin
Giftige und gefährliche radioaktive Gesteine und Mineralien
** - Giftige Steine und Mineralien (Pflichtprüfung in der chemischen Labor + klare Anzeichen von Toxizität)
** - Radioaktive Gesteine und Mineralien (obligatorische Überprüfung in regelmäßigen Dosimeter + Verbot der freien Verkauf von Radioaktivität im Falle von mehr als 24 mR / h + zusätzliche Maßnahmen zum Schutz der Bevölkerung)
Katalog Mineralien und Edelsteine in Gruppen der Welt
** - Giftige Steine und Mineralien
** - Radioaktive Gesteine und Mineralien


Kommentare
im Auge kommentierte halten , dass der Inhalt und der Ton Ihrer Nachrichten , die Gefühle von echten Menschen verletzen können, Respekt und Toleranz gegenüber seinen Gesprächspartnern, auch wenn Sie Ihr Verhalten in Bezug auf die Meinungsfreiheit und die Anonymität des Internets, ändert ihre Meinung nicht teilen, nicht nur virtuell, sondern realen Welt. Alle Kommentare werden aus dem Index, Spam - Kontrolle versteckt.